- DOI: 10.1002/chemv.201500041
- Author: Klaus Roth
- Published Date: 02 Junho 2015
- Source / Publisher: Chemie in unserer Zeit/Wiley-VCH
- Copyright: Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim
- Reproduced with permission.
Tradução autorizada do texto ‘Strychnine: From Isolation to Total Synthesis – Part 2‘
Depois de examinar a estricnina dos pontos de vista histórico, médico e forense, esboçamos como sua estrutura molecular foi determinada.
3. O Tedioso Processo de Estabelecimento da Estrutura da Estricnina
O primeiro passo dado no sentido de determinar a estrutura da estricnina foi o estabelecimento de sua fórmula molecular: C21H22N2O2, o que foi realizado já na década de 1830 [17]. Dado que a partir dessa fórmula molecular alguém poderia propor milhões de isômeros distintos, uma abordagem mais próxima para entender como os 21 átomos de carbono estavam conectados exigiu degradação química gradual. Foram feitas tentativas de desmontar a estricnina usando virtualmente todas as reações disponíveis para os químicos da época, na esperança de liberar moléculas menores e mais simples com estruturas que já eram conhecidas. Pensou-se que isso pelo menos produziria um insight sobre fragmentos relevantes para o quebra-cabeça estrutural geral.
Isso provou ser um negócio extremamente árduo, especialmente porque o ponto de partida para cada uma das reações de degradação era muito incerto. Isso implicava não apenas habilidade, diligência e resistência, mas também um pouco de sorte, e esta última aparentemente não estava disponível em grandes quantidades para os “estricninistas” químicos, porque a jornada da fórmula molecular à fórmula estrutural durou mais de um século. Imagine o nível de frustração que gerações de químicos devem ter experimentado quando os literalmente quilos de estricnina cristalina à sua disposição não puderam ser induzidos a revelar os segredos do composto [18].
Não podemos discutir em detalhes todas as idas e vindas associadas às muitas sugestões estruturais feitas, mas uma olhada na Fig. 2 fornece uma visão geral limitada da evolução das fórmulas estruturais da estricnina. Ao longo de mais de 100 anos, milhares de cientistas se envolveram, entre eles gigantes intelectuais como Sir Robert Robinson (Prêmio Nobel de 1947), Vladimir Prelog (Prêmio Nobel de 1975), Heinrich Wieland (Prêmio Nobel de 1928) e Robert Burns Woodward (Prêmio Nobel de 1965). Vladimir Prelog, que estabeleceu em 1945 que o segundo átomo de nitrogênio era parte de um anel de seis membros (não de cinco membros), observou em sua autobiografia que “Não há outro composto orgânico cuja determinação de estrutura tenha exigido tanto esforço experimental e intelectual como estricnina “[19].
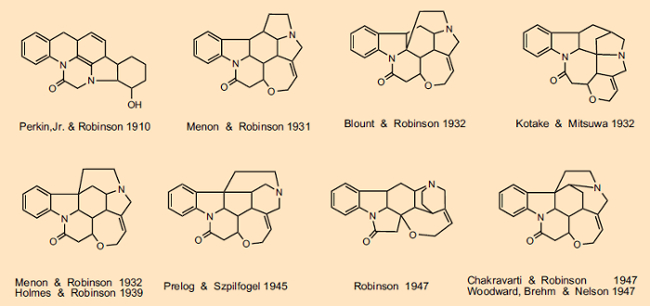
No que diz respeito à competição empolgante presente, o Monte Everest estrutural da química de produtos naturais orgânicos, não faltou entre os participantes de primeira linha, mortificação pessoal ou confrontos sem cerimônia [20]. Assim, Woodward descartou uma proposta estrutural oferecida por Robinson na primavera de 1947 como “pura fantasia” [20, 21]. No entanto, uma esposta olho por olho não demorou a vir. Em sua palestra para o Prêmio Nobel de dezembro de 1947, Robinson fez menção explícita a Hermann Leuchs, cujo grupo foi responsável por 125 publicações sobre o assunto da estricnina, e Vladimir Prelog, que contribuiu com a prova definitiva de que o átomo de nitrogênio terciário deve fazer parte de um grupo 5 anel de membros, mas não disse uma sílaba sobre Woodward [22], que na arrancada final em direção à estrutura da estricnina fez contribuições significativas e, independentemente de Robinson, de fato chegou ao resultado correto.
4. A Primeira Síntese Total de Woodward – Em artigo (1948)
Após o isolamento da estricnina (1828) e determinação de sua estrutura (1947), que foi finalmente garantida por meio de análise de raios-X em 1950 [23-25], tudo o que estava faltando como culminação adequada era uma síntese total. A avaliação de Sir Robert Robinson de que “por seu tamanho molecular, é a mais complexa de todas as substâncias” [26], implicava que realizar tal feito estava ainda longe. Uma olhada na fórmula estrutural da Fig. 3 pareceria substanciar seu pessimismo: o emaranhado de sete anéis só pode ser apreciado em um sentido tridimensional após prolongada consideração. Com uma molécula como a estricnina, que é tão complexa tridimensionalmente, nenhuma representação única é adequada para transmitir todos os detalhes estruturais relevantes. A reconstrução sintética de tal labirinto de átomos de carbono parecia absolutamente impossível.
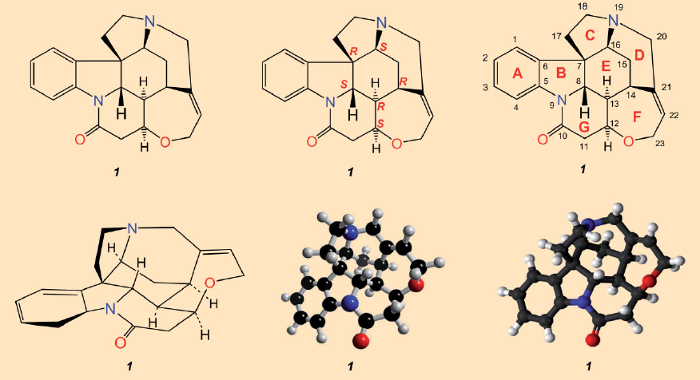
Acima: a fórmula estrutural mais comumente empregada (esquerda), indicando configurações para os seis átomos de carbono estereogênicos (centro), e numerações de átomos junto com as designações alfabéticas para os sete anéis, conforme originalmente empregadas por Woodward (direita).
Embaixo: uma representação em perspectiva.
Apenas uma pessoa se atreveu a enfrentar o mais ousado dos desafios sintéticos: Robert Burns Woodward (1917–1979) [27]. Ele achava que a abordagem mais promissora para desenvolver uma estratégia sintética era seguir o exemplo da natureza; isto é, em tudo, desde os materiais iniciais até as etapas individuais de reação, apoiando-se na via sintética presumivelmente empregada pelas plantas. Nesse caso, ele estava pisando em terreno um tanto instável, já que todos naquela época não conheciam as verdadeiras origens biossintéticas dos alcalóides, em particular porque os métodos isotópicos de estudo ainda não haviam sido desenvolvidos. A situação mudou apenas em meados dos anos 1950, quando as técnicas foram dominadas para rastrear o destino de átomos de carbono individuais durante o metabolismo, aproveitando a marcação específica com átomos 13C ou 14C no lugar do muito mais comum 12C (traços de 14C são detectável por sua radioatividade distinta e quantidades razoáveis de 13C por espectrometria de massa).
4.1 Biossíntese de alcaloides
Na época, as ideias geralmente aceitas sobre a biossíntese de alcaloides baseavam-se menos em evidências experimentais do que na imaginação e intuição dos químicos orgânicos. É claro que nem tudo era consequência de se agarrar a incertezas: certas experiências de laboratório ofereciam pelo menos algum potencial para nos orientarmos. Um trabalho inovador neste sentido veio em 1916 de Amé Pictet e Tsan Quo Chou [28].
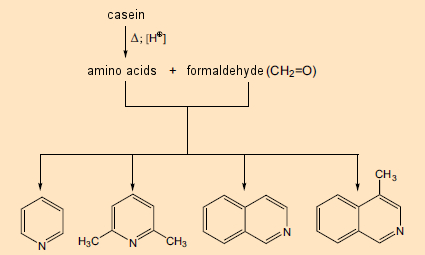
Seu estudo começou com caseína, uma conhecida mistura de quatro proteínas, derivada do leite de vaca e consistindo de 160–210 aminoácidos quimicamente ligados. Eles aqueceram este material por seis horas com formaldeído em ácido clorídrico aquoso. Sob tais condições, o que ocorre primeiro é a liberação dos aminoácidos individuais, que então reagem com o formaldeído, levando, entre outras coisas, a heterociclos contendo nitrogênio, como a piridina (Fig. 4, à esquerda) e a isoquinolina (à direita). Esses já eram conhecidos por estarem entre os blocos de construção de vários componentes das plantas, mas sua própria biossíntese na época ainda era um mistério.
A piridina e a isoquinolina em particular eram conhecidas por contribuírem para as estruturas de muitos alcalóides. Ainda na década de 1960, esse fato serviu de base para uma noção firmemente ancorada de que os alcalóides eram, em última instância, derivados da reação entre aminas livres (decorrentes de aminoácidos) e aldeídos, onde o parceiro da reação aldeídica pode ser um metabólico de baixo peso molecular produto como o formaldeído. O princípio sintético “amina (aminoácido) + aldeído (aminoácido ou metabólito) → alcalóide” era especialmente atraente por sua simplicidade. De fato, com certos alcalóides como a papaverina e a laudanosina, que ocorrem no ópio da papoula, o papel de um par de precursores de aminoácidos parece bastante aparente (Fig. 5).
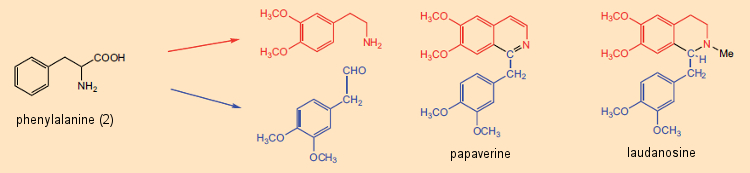
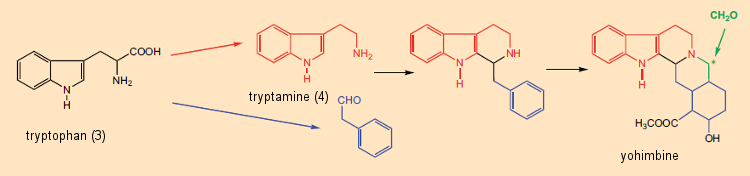
A dissecção formal de alcalóides em componentes de aminoácidos foi útil não apenas na elucidação da estrutura, mas também para o inverso: isto é, os químicos começaram, no papel, a propor sínteses de alcalóides com base neste “princípio metabólico”. Um exemplo especialmente impressionante é a síntese “semelhante a biossintética” sugerida por G. Barger e G. Hahn [29,30] de ioimbina (Fig. 6), encontrada na casca da árvore africana Pausinystalia yohimbe. Uma via biossintética plausível para a ioimbina poderia então ser imaginada como envolvendo a reação inicial entre a triptamina (derivada do triptofano) e o fenilacetaldeído (a partir da fenilalanina), seguida pela reação com o formaldeído.
4.2 O plano inicial de Woodward para uma síntese de estricnina
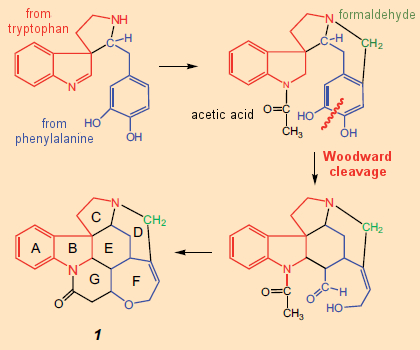
É apenas nesse contexto que se pode seguir o plano sintético inicial de Woodward para a estricnina (Fig. 7). Moldado pela noção de que os alcaloides são derivados na natureza de aminoácidos, elaborados apenas por componentes relativamente pequenos como formaldeído ou ácido acético, Woodward concebeu (no papel) o conceito sintético: AB → C → D → E → FG.
A modéstia dificilmente seria a característica mais notável de Woodward, aliás, como ilustrado por exemplo pelo título ambicioso que ele atribuiu à sua publicação de 1948: “Biogenesis of the Strychnos Alkaloids” [31], cuja mensagem ele então resumiu com as palavras:
“No geral, a possibilidade de construir uma estrutura tão complicada como (VI) por uma série de reações simples a partir de materiais de partida plausíveis é tão impressionante que é difícil acreditar que o esquema carece de significado.”
Na fórmula estrutural da estricnina, uma subunidade da triptamina (4) realmente pareceria inconfundível, constituindo os anéis A e B e uma porção do anel C. Por outro lado, não há aminoácidos imediatamente óbvios dentro do aglomerado confuso que forma os anéis D – G . Mas Woodward viu um: ele agarrou-se a uma ideia proposta em 1948 por Barger e Hahn e foi persuadido de que poderia decifrar nesse emaranhado uma unidade de fenilalanina, cujo anel aromático deve ter sido destruído durante a biossíntese.
Com base nessa ideia ousada como uma característica central, ele publicou em 1948 – apenas um ano após a determinação da estrutura – seus pensamentos sobre uma biossíntese potencial para a estricnina (Fig. 7) [31], notando claramente, no entanto, que esta sugestão biossintética pode não ser correta em todos os detalhes e, portanto, devem ser interpretada de forma flexível.
A ideia de abrir um anel fenil foi recebida com entusiasmo. Por exemplo, em um adendo à publicação de Woodward, Robinson observou: “A proposta de abertura de um anel de benzeno é original ao extremo … É aparente que ao quebrar um anel de benzeno e depois remontar os fragmentos, virtualmente qualquer estrutura pode ser montada . ” Apenas algumas semanas depois, o próprio Robinson empregou o conceito de clivagem do anel no curso da solução da estrutura da emetina, elogiando a “ideia engenhosa” de Woodward e referindo-se à etapa de abertura do anel como uma “clivagem de Woodward” [32].
4.3 Laboratório de síntese total de Woodward (1954)
“Se não conseguirmos, nós aceitaremos” Esse comentário foi atribuído a Woodward e certamente é consistente com seu senso de humor sarcástico. Se ele realmente disse isso, no entanto permanece incerto.
Nessa época, Woodward já havia sintetizado quinina (1944), patulina e cortisona (1951), e havia publicado em 1954 a síntese total de ácido lisérgico e lanosterol. Mas a sensação absoluta neste ano foi sua síntese total de estricnina [33, 34]! Apenas sete anos após a elucidação de sua estrutura, ele e cinco colegas de trabalho conseguiram preparar o produto natural – em 29 etapas, usando produtos químicos de laboratório conhecidos. É verdade que o rendimento geral era inferior a 0,1%, mas isso não importava, pois o importante era demonstrar que era possível preparar em laboratório uma molécula tão complexa como a estricnina.
Por suas realizações no campo da síntese de produtos naturais, Woodward foi finalmente recompensado, em 1965, com o tão esperado Prêmio Nobel de Química. O discurso de apresentação oficial, proferido na cerimônia de premiação, concluiu com palavras cujo nível de elogio dificilmente poderia ter sido ultrapassado [35]:
“Às vezes se diz que você demonstrou que nada é impossível na síntese orgânica. Talvez seja um pequeno exagero. Você, porém, de forma espetacular expandiu e ampliou o domínio do possível. Diz-se também que você se destaca como um mago. Sabemos que no passado, a química foi classificada como uma ciência oculta. De qualquer forma, você certamente não ganhou sua reputação científica por meios mágicos, mas pela intensidade penetrante de seu pensamento químico e o rigoroso planejamento especializado de seus experimentos. Nestes aspectos, você ocupa uma posição única entre os químicos orgânicos de hoje. Em reconhecimento aos seus serviços à Ciência Química, a Royal Academy decidiu conferir a você o Prêmio Nobel deste ano por suas realizações notáveis na arte da síntese orgânica . “
Não é possível para nós aqui apresentar em detalhes toda a verdadeira arte demonstrada na síntese de estricnina de Woodward de 1954; mas outros mais qualificados já o fizeram freqüentemente [36, 37]. Em vez disso, nos limitamos à surpresa com a qual começou, que atordoou os químicos então, e ainda o faz (Fig. 8).
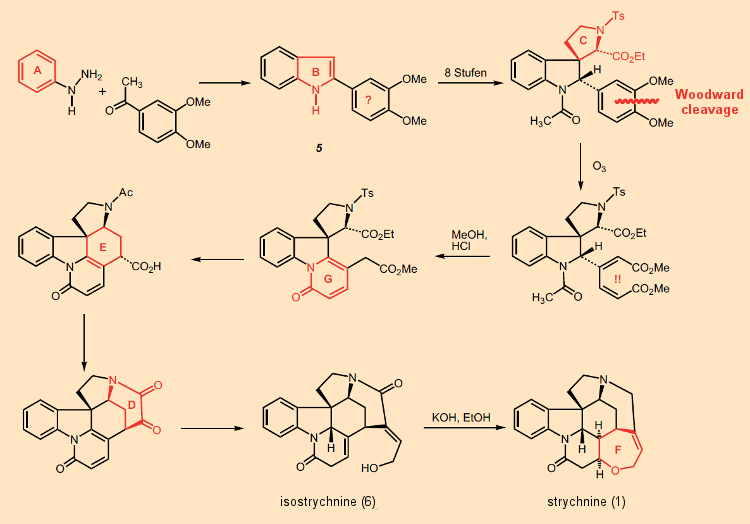
Para começar, os anéis A e B do sistema indol foram montados, e então – passo a passo – os anéis G, E e D foram adicionados. Desde o início, provou-se impossível se conformar com seu esquema sintético original, a saber (AB) → C → D → E → (FG), uma vez que uma reação de substituição de uma unidade de fenilalanina no triptofano não ocorreu na posição 3, conforme desejado, mas sempre na posição 2. Assim, Woodward bloqueou essa posição com um substituinte fenil introduzido por meio de uma síntese de indol de Fischer, que tornou possível construir subsequentemente o anel C sem interrupção; assim, no geral: (AB) → C → G → E → D → F.
O último dos anéis, F, fecha-se no curso da isomerização familiar de isostricnina (6) em estricnina [38]. A síntese começa com um ritmo furioso: a introdução aparentemente inútil de um resíduo de dimetoxifenil no indol 5. O “momento aha” associado vem apenas após 9 etapas de reação, ou seja, com a ruptura do anel fenil usando ozônio, sendo os dois fragmentos então utilizados como uma espécie de “pedreira” molecular [39] como forma de montar os anéis G e E. Simplesmente genial!
A introdução do anel fenil substituído com dimetoxi no início usando uma síntese de indol de Fischer parece à primeira vista totalmente inútil. Só depois de várias etapas subsequentes é que vemos a solução para este quebra-cabeça confuso: o anel aromático é clivado com ozônio. O curso de ação bastante incomum torna-se inteligível, no entanto, quando visto contra um pano de fundo das noções sintéticas bioquímicas apresentadas anteriormente. Isso, a saber, o levou a considerar a fenilalanina como um precursor bioquímico da estricnina!
4.4 O fim da clivagem de Woodward
Estudos isotópicos no início dos anos 1960 mostraram que em todos os alcaloides indólicos a porção indol era derivada do aminoácido triptofano. Na maioria dos casos, esta unidade indol foi construída a partir de triptamina – por sua vez, do triptofano – juntamente com o módulo de terpeno C10 secologanina. Muitos dos mais de 3.000 exemplos de tais alcaloides indólicos terpenóides têm estruturas complexas fascinantes. A secologanina (7) é sintetizada em plantas a partir do geraniol (8), uma subunidade chave na biossíntese de terpeno [40]. Este princípio sintético foi confirmado através de estudos isotópicos por volta de 1961 por E. Wenkert e R. Thomas [41, 42], representando um fim abrupto para a ideia de “Clivagem de Woodward” [43]. A natureza de fato sintetiza estricnina de uma maneira diferente daquela originalmente imaginada por Woodward (Fig. 9): não a partir de triptofano e fenilalanina, mas sim de triptofano (3) e secologanina (7), é como a “árvore de noz venenosa” fabrica sua estricnina.
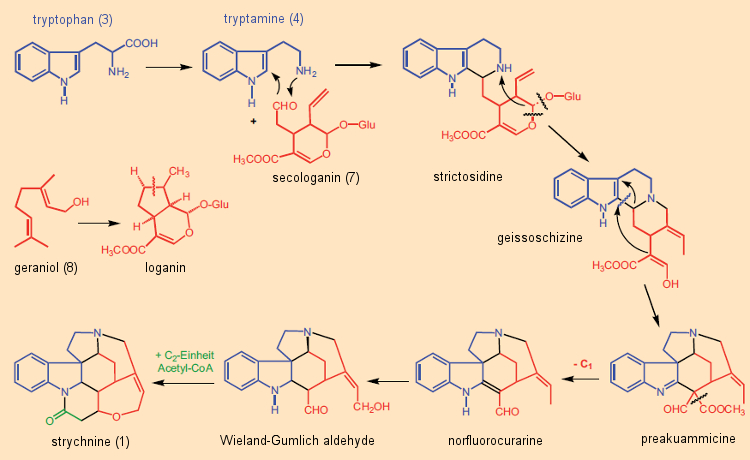
A secologanina (7) reage no decurso de uma reação de Mannich com a triptamina (4) para dar a estritosidina, um intermediário na formação de inúmeros alcalóides indólicos. A etapa final na biossíntese da estricnina é a incorporação de uma unidade C2 (acetil-CoA, ácido acético ativado) no chamado aldeído Wieland-Gumlich (9), seguido por um fechamento final do anel.
Resumindo tudo:
por décadas, Robinson, Woodward e seus contemporâneos seguiram a premissa de que a natureza faz seus alcalóides a partir de aminoácidos. Com base nisso, muitas descobertas puderam ser explicadas de maneira convincente, dicas importantes foram adquiridas no curso das determinações da estrutura e o planejamento sintético foi facilitado. Muitas sínteses planejadas dessa maneira foram implementadas com sucesso, como no caso aqui da brilhante síntese de estricnina de Woodward.
De uma perspectiva atual, o caminho biogenético que Woodward postulou originalmente para a estricnina, centrado na clivagem de um anel de benzeno, era muito criativo, mas estava errado. Felizmente, no entanto, uma vez que se Woodward estava ciente em 1949 da via biossintética real, como mostrado na Fig. 9, e se ele, com as ferramentas de reação então disponíveis, tivesse tentado uma síntese total com base neste conhecimento, é muito duvidoso que ele teria conseguido.Portanto, se nós também nos encontrarmos em terreno instável com nossos pensamentos e sonhos, sejamos corajosos e ousados e sigamos o conselho do grande filósofo Karl Valentin: [44]
Diretor musical: “… aliás, o que eu vejo aí? Você não tem nenhuma lente na armação dos seus óculos! … Por que você coloca uma armação vazia? Não adianta.”
Karl Valentin: “É melhor do que nada!”
Referências
[17] V. Regnault, Liebigs Ann. Chem. 1838, 26, 10. DOI: 10.1002/jlac.18380260103
[18] S. Berge, D. Sicker, Classics in Spectroscopy, Wiley-VCH, Weinheim, Germany, 2009. ISBN: 978-3-527-32516-0
[19] V. Prelog, My 132 Semesters of Studies in Chemistry, American Chemical Society, Washington D.C., USA, 1991. ISBN: 78-0-8412-1772-0
[20] J. A. Berson, Chemical Discovery and the Logicians’ Program, Wiley-VCH, Weinheim, Germany, 2003. ISBN: 78-3-527-30797-5
[21] R. Robinson, Nature 1947, 159, 263. DOI: 10.1038/159263a0
[22] R. Robinson, Some polycyclic natural products (Nobel Lecture), 1947. http://nobelprize.org/nobel_prizes/chemistry/laureates/1947/robinson-lecture.pdf
[23] J. H. Robertson, C. A. Beevers, Nature 1950, 165, 690. DOI: 10.1038/165690a0
[24] J. H. Robertson, C. A. Beevers, Acta Cryst. 1951, 4, 270. DOI: 10.1107/S0365110X5100088X
[25] A. F. Peerdeman, Acta Cryst. 1956, 9, 824. DOI: 10.1107/S0365110X56002266
[26] R. Robinson, Progr. Org. Chem. 1952, 1, 2.
[27] D. M. S. Wheeler, Chem. Unserer Zeit 1984, 18, 109. DOI: 10.1002/ciuz.19840180402
[28] A. Pictet, T. Q. Chou, Ber. Dtsch. Chem. Ges. 1916, 49, 376. DOI: 10.1002/cber.19160490143
[29] G. Barger, C. Scholz, Helv. Chim. Acta 1933, 16, 1343. DOI: 10.1002/hlca.193301601167
[30] G. Hahn, H. Ludewig, Ber. Dtsch. Chem. Ges. 1934, 67, 2031. DOI: 10.1002/cber.19340671221
[31] R. B. Woodward, Nature 1948, 162, 155. DOI: 10.1038/162155a0
[32] R. Robinson, Nature 1948, 162, 524. DOI: 10.1038/162524a0
[33] R. B. Woodward et al., J. Am. Chem. Soc. 1954, 76, 4749. DOI: 10.1021/ja01647a088
[34] R. B. Woodward et al., Tetrahedron 1963, 19, 247. DOI: 10.1016/S0040-4020(01)98529-1
[35] Professor A. Fredga, Award Ceremony Speech, 1965. http://nobelprize.org/nobel_prizes/chemistry/laureates/1965/press.html
[36] K. C. Nicolaou, E. J. Sorensen, Classics in Total Synthesis, Wiley-VCH, Weinheim, Germany, 1996. ISBN: 978-3-527-29231-8
[37] T. Hudlicky, J. W. Reed, The Way of Synthesis, Wiley-VCH, Weinheim, Germany, 2007. ISBN: 978-3-527-32077-6
[38] V. Prelog et al., Helv. Chim. Acta 1948, 31, 2244. DOI: 10.1002/hlca.19480310750
[39] J. Mulzer, Nachr. Chem. 2007, 55, 731 (in German). DOI: 10.1002/nadc.200746724
[40] P. M. Dewick, Medical Natural Products, 3rd Edition, John Wiley & Sons, Chichester, 2009. ISBN: 978-0-470-74168-9
[41] E. Wenkert, J. Am. Chem. Soc. 1962, 84, 98. DOI: 10.1021/ja00860a023
[42] R. Thomas, Tetrahedron Lett. 1961, 2, 544. DOI: 10.1016/S0040-4039(01)91645-4
[43] A. R. Battersby, Pure Appl. Chem. 1967, 14, 117. DOI: 10.1351/pac196714010117
[44] E. Heilbronner, H. Bock, Das HMO-Modell und seine Anwendung, Verlag Chemie, Weinheim, Germany, 1968. (in German).
Texto traduzido por Prof. Dr. Luís Roberto Brudna Holzle ( luisbrudna@gmail.com). A tradução do original ‘Strychnine: From Isolation to Total Synthesis – Part 2’ foi gentilmente autorizada pelos detentores dos direitos.
PARTE 1 – Estricnina: do isolamento à síntese total
PARTE 2 – Estricnina: Do Isolamento à Síntese Total