Como fazer piridina. A fedida!


A piridina é muito utilizada em química orgânica, como solvente e principalmente como precursor de diversas outras substâncias. A estrutura da piridina já dá uma pista de que é um composto fundamental no laboratório.
O canal NileRed mostra como a piridina pode ser obtida a partir da niacina (vitamina B3) por meio de um processo de descarboxilação.
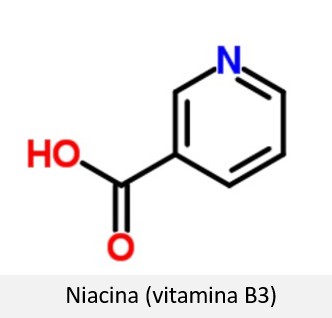
O procedimento demonstrado no vídeo foi feito com 50 gramas de niacina (vitamina B3) e 12 gramas de carbonato de cobre básico [Cu2CO3(OH)2]. Os detalhes técnicos de como o experimento deve ser realizado e o produto purificado estão bem explicados no vídeo.
Vídeo com legenda em português. Ative a legenda pelo Youtube (veja como).
O resultado relatado foi de 15 ml de piridina; ou seja, um rendimento de 46%.
Uma observação importante é que o canal NileRed é de química realizada de forma amadora. Portanto os procedimentos não são necessariamente os mais eficientes e/ou limpos.
O experimento somente deve ser realizado em laboratório devidamente equipado e com uso de itens de segurança. A piridina é tóxica e possui um desagradável cheiro de peixe.
Texto e legenda escritos por Prof. Dr. Luís Roberto Brudna Holzle ( luisbrudna@gmail.com ).

 Clique aqui para baixar (PDF).
Clique aqui para baixar (PDF).