Moléculas essenciais para a vida em meteoritos


Fragmentos do meteorito Sutter’s Mill
Análises de fragmentos do meteorito batizado de ‘Sutter’s Mill‘, que iluminou o céu da Califórnia (EUA) no dia 24 de abril de 2012, foram realizadas e nestas os pesquisadores descobriram que moléculas orgânicas essenciais para a vida estavam presentes no material deste meteorito.
Meteoritos são fragmentos de planetas, poeira cósmica, asteroides… variam de tamanho e conseguem resistir à entrada na atmosfera terrestre, atingindo o solo. Alguns tipos de meteoritos, classificados como condritos carbonáceos, compostos orgânicos, inclusive do mesmo tipo de substâncias encontradas na Terra.
As hipóteses feitas até hoje sustentam normalmente que a origem da vida é baseada em evidências de que ela teria surgido em uma espécie de uma sopa “prebiótica” (que conteria elementos e compostos como: carbono (C), hidrogênio (H), potássio (K), amônia (NH3), nitrogênio (N2), magnésio (Mg) e água (H20)), sendo uma parte desses talvez trazidos por meteoritos.
Para Sandra Pizzarello, bioquímica e chefe de estudos da Universidade Federal do Arizona, em Tempe, comenta que “A sua composição sempre foi vista como uma indicação de que os precursores da evolução que levou às origens da vida poderiam ter vindo de material extraterrestre carregado em meteoritos”.
Pizzarello e seus colegas analisaram dois fragmentos do meteorito Sutter’s Mill, dissolvendo-os com solvente, e viram que aparentemente possuía poucos compostos orgânicos dissolvíveis comparando-o com outros meteoritos similares.
Alguns dos compostos encontrados no meteorito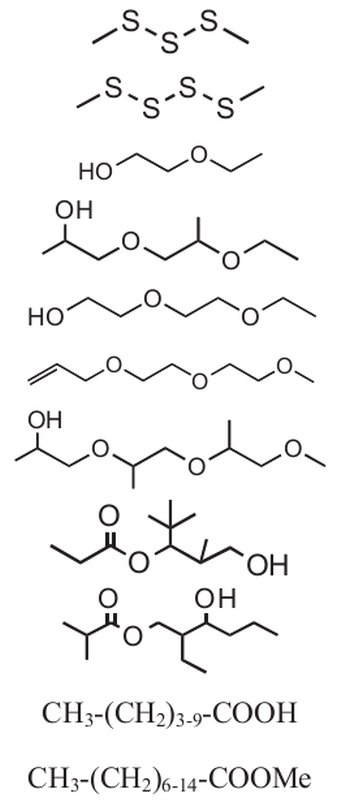
“Voce poderia dizer que isso foi uma decepção”, disse Pizzarello.
Contudo, os pesquisadores dissolveram fragmentos do meteorito em outras condições que imitam as fontes hidrotermais da Terra, que era o ambiente primórdio da Terra, o qual poderia ter surgido a vida. Através destes aspectos, foi visto que nessas condições um tanto diferentes os fragmentos liberaram moléculas orgânicas que não haviam sido detectadas em meteoritos similares. O estudo comprovou que há muito mais material orgânico disponível nos meteoritos do que os cientistas pensavam.
“o que pode ser bom para um propósito, porque eles podem atuar como cápsulas rudimentares que conteriam compostos úteis na evolução prebiótica,” comentou Pizzarello.
Artigo original sobre o meteorito:
Processing of meteoritic organic materials as a possible analog of early molecular evolution in planetary environments
Sandra Pizzarello, 15614–15619, doi: 10.1073/pnas.1309113110
Texto escrito por Bruna Lauermann.





