Automatização em química

Prof. Martyn Poliakoff festeja a publicação de um artigo que trata de aprimoramento de reações químicas de forma contínua e auto otimizadas.
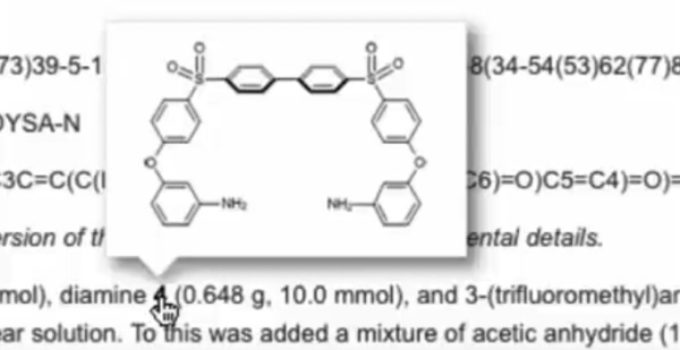
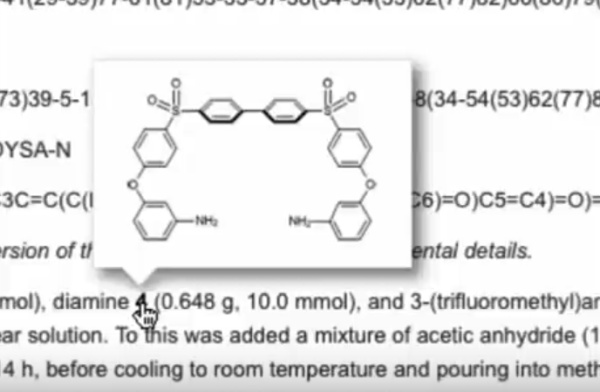
A mudança de diversas variáveis para testar a otimização de uma reação pode ser um processo demorado, trabalhoso e caro. Pensando em facilitar estes procedimentos, alguns químicos trabalham em montagens de equipamentos que permitam fazer estas tentativas de forma automática e auto otimizada.
Veja como Martyn conseguiu isto em reações em meio de dióxido de carbono supercrítico.
Vídeo com legendas em português. Para ativar, clique em play e depois no botão CC para selecionar a legenda.
Leia o artigo em
Parrott, A., Bourne, R., Akien, G., Irvine, D., & Poliakoff, M. (2011). Self-Optimizing Continuous Reactions in Supercritical Carbon Dioxide Angewandte Chemie International Edition, 50 (16), 3788-3792 DOI: 10.1002/anie.201100412