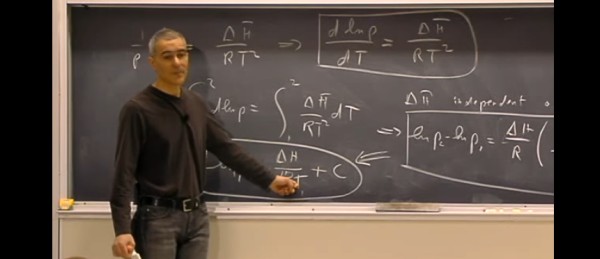
Neste vídeo o professor demonstra a equação de Clausius-Clapeyron, e suas correlações.
No início ele comete um erro com a inclinação da fronteira entre o sólido e líquido para o diagrama de fases da água, mas logo após corrige o erro.
A aula é encerrada com a ´Regra das fases de Gibbs´.
Aula 19
(em inglês, sem legendas)
Categoria: Físico-química
Equação de Clausius-Clapeyron – Aula no MIT
Calor humano

Para montar este experimento você vai precisar de:
– Frasco pequeno com tampa
– Martelo e prego (para furar a tampa)
– Canudinho
– Cola (ou outro material para vedar o espaço entre o canudinho e a tampa)
– Água com corante (para facilitar a visualização)A ideia é simples. Basta colocar um pouco de água dentro do frasco e fechar. Após isto envolva o frasco com as mãos. Se as suas mãos estiverem quentes o ar dentro do frasco vai se expandir um pouco empurrando a água pelo canudinho. Lembre que o canudinho deve estar com a ponta inferior dentro da água que está no frasco.
Este fenômeno pode ser explicado pela equação de clapeyron (gás ideal). PV=nRT
Existe portanto uma proporcionalidade da temperatura com a pressão e volume.Fonte:
http://fq-experimentos.blogspot.com/2008/04/calor-humano.htmlMaterial obtido com a contribuição de Dison Franco.
Veja também:
Composição humanaIniciando fogo com ar comprimido
Se você estiver em casa, sem energia elétrica e sem fósforos, e precisar cozinhar algo rapidamente em seu fogão. Como faria para acender a chama?
Talvez esfregando alguns gravetos, como nos filmes? Não funciona com tanta facilidade como parece.
Um químico poderia lembrar que uma lã de aço pode queimar ao entrar em contato com uma pilha simples (pilhas de 9V são mais fáceis de usar neste caso). Mas seria necessário lã de aço e uma pilha (ou bateria), e se você for um solteiro que mora sozinho, terá dificuldade de encontrar esses materiais em casa! 🙂Uma solução é utilizar um pistão de fogo. Este aparato é composto de um pequeno cilindro fechado em uma extremidade e um pistão com um pequeno espaço oco na ponta. Dentro da ponta oca do pistão é necessário colocar uma pequena quantidade de algodão ou de material que fácil combustão, como musgo bem seco.
Ao se pressionar com muita rapidez o pistão, o ar dentro se aquece rapidamente. Este efeito ocorre por causa da compressão adiabática, no qual o gás aquece ao ser comprimido com rapidez.
Este é um processo semelhante ao que ocorre em um motor a Diesel, no qual não existe a faísca durante ciclo e a ignição do combustível ocorre pelo calor obtido na compressão da mistura ar-combustível.Veja o funcionamento no vídeo abaixo:

Pistão de fogo para ser utilizado em acampamento.Fonte: Gray Matter
Texto escrito por Prof. Dr. Luís Roberto Brudna Holzle ( luisbrudna@gmail.com ) – Universidade Federal do Pampa – Bagé.
Expansão da água

O que pode ocorrer se impedirmos a expansão da água no momento em que esta congela?A água, ao passar da fase líquida para a fase sólida (gelo) sofre uma expansão, ao contrário da maioria das outras substâncias. Quando em pressão atmosférica, a água ao congelar chega a expandir em 9% o seu volume. Esta variação de volume pode ser suficiente para romper um recipiente fechado na qual está contida.
Veja o que ocorre ao se congelar água que está dentro de um cano metálico fechado nas duas pontas.
O mesmo efeito foi também demonstrado com um cano de plástico.Para congelar mais rapidamente a água o apresentador utilizou nitrogênio líquido.
Todo o tipo de experimento deve sempre ser realizado somente por especialistas e com uso de equipamento de proteção.
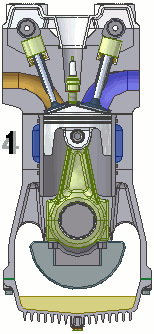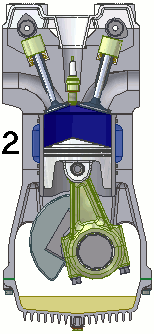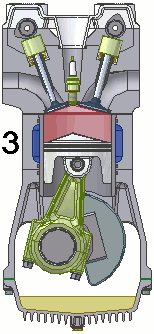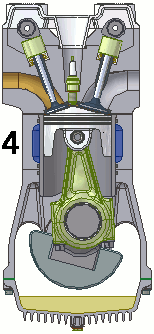
Dentro de um motor
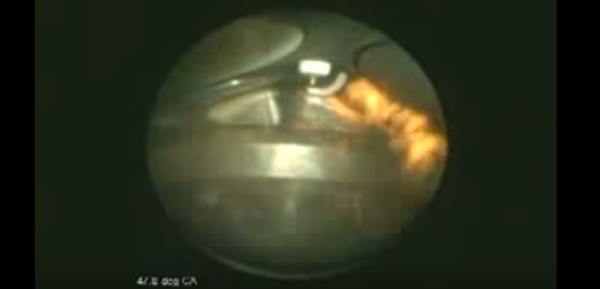
Em um motor de 4 tempos podemos resumir o processo em uma admissão de combustível, seguida por uma compressão, uma combustão e finalizada por uma exaustão.
No vídeo abaixo é possível ver quase todo este ciclo, inclusive com o detalhe da faísca que inicia a combustão. Pena que a parte da exaustão foi cortada do vídeo.
A animação abaixo esquematiza todo o ciclo.
Mais informações podem ser obtidas em
https://pt.wikipedia.org/wiki/Ciclo_de_Otto
inclusive com uma representação do modelo ideal do ciclo e explicações sobre os motores de múltiplas válvulas.Água, ácido acético e acetato de etila

No vídeo abaixo uma demonstração de miscibilidade de líquidos é feita iniciando com uma mistura de 25% ácido acético e 75% água (em proporção mássica).
A cor azul for inserida simplesmente para facilitar a visualização do processo.
Após isto eles adicionaram lentamente o acetato de etila (um líquido claro) até forçar o sistema a separar em duas fases líquidas distintas.
As proporções em que o ácido acético +água + acetato de etila formam duas fases podem ser representadas em um diagrama ternário. Infelizmente não disponho do diagrama para este exemplo específico.
Texto escrito por Prof. Dr. Luís Roberto Brudna Holzle ( luisbrudna@gmail.com ) – Universidade Federal do Pampa – Bagé.