Energia de Gibbs – aula no MIT
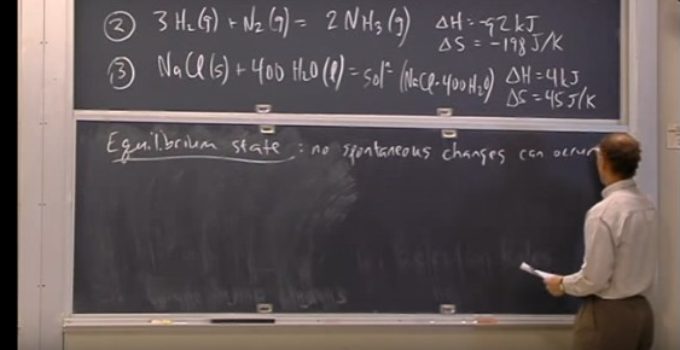
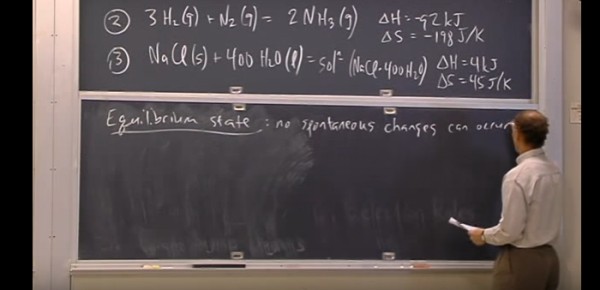
Nesta aula é feita de demonstração da importância da energia de Gibbs como critério de espontaneidade de um processo.
Na construção do conceito ele também aborda a energia de Helmholtz.
Aula 12 (em inglês)
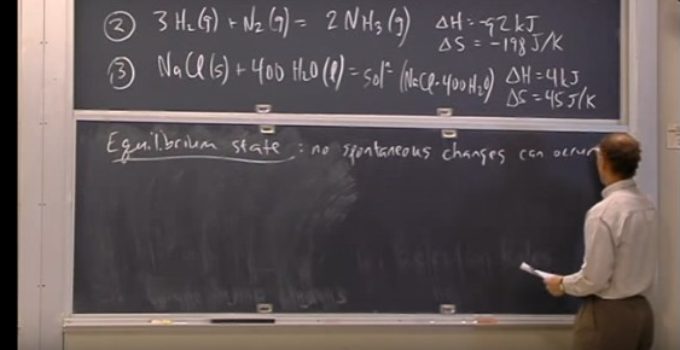
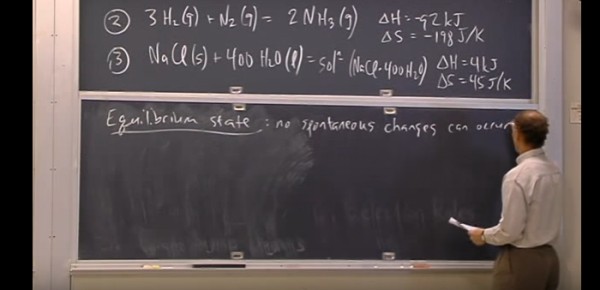
Nesta aula é feita de demonstração da importância da energia de Gibbs como critério de espontaneidade de um processo.
Na construção do conceito ele também aborda a energia de Helmholtz.
Aula 12 (em inglês)


As máquinas térmicas funcionam em situações em que existe uma diferença de temperatura (fonte quente e fonte fria). Nem sempre é fácil visualizar que é possível obter trabalho com essa diferença.
Um exemplo simples e direto é com um motor de Stirling. No vídeo o funcionamento com as diferenças de temperatura fica bem evidente. Eles demonstram que o motor funciona abastecido com o calor de uma xícara de café, ou então com o frio fornecido por cubos de gelo. No primeiro caso o ambiente é a fonte fria e no segundo é a fonte quente.
O modelo demonstrado por ser encontrado à venda na internet, por 429 dólares.


O fato do mercúrio ser líquido em temperatura ambiente está relacionado com a sua temperatura de fusão, que é de -38.83 °C.
Então, para obter mercúrio sólido, você deverá resfriar a uma temperatura abaixo deste patamar.
Um modo prático de se obter temperaturas baixas é resfriando com nitrogênio líquido (aproximadamente -200 °C).
Veja como fazer alguns objetos usando aqueles moldes para doces.
É uma pena que o mercúrio seja tóxico, pois a brincadeira poderia ser bem interessante.
A camada branca formada sobre os moldes é devido ao congelamento do vapor de água.
Veja também
Fusão de metal em água quente
Via PopSci
Texto escrito por Prof. Dr. Luís Roberto Brudna Holzle ( luisbrudna@gmail.com ) – Universidade Federal do Pampa – Bagé.

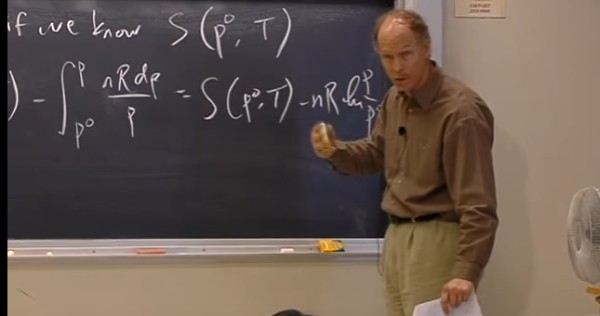
Nesta aula é comentada a variação da entropia com a temperatura e nas mudanças de estado. Isto como forma de introduzir para a questão referente ao valor da entropia no zero absoluto e sua relação com a terceira lei da termodinâmica.
A aula está um pouco confusa e não possui a mesma qualidade das outras deste mesmo curso (MIT 5.60).
Aula 11


Assista o vídeo abaixo.
A explicação:
Na verdade, o que ele usa não é água.
Provavelmente ele está usando uma solução supersaturada com algum sal. Na internet existem diversos vídeos explicando como supersaturar uma solução com acetato de sódio. Talvez tenham utilizado a mesma técnica.
Para supersaturar com acetato de sódio basta dissolvê-lo em grande quantidade em água quente. Ao resfriar lentamente a mistura qualquer perturbação iniciará o processo de cristalização do acetato de sódio em solução.
No vídeo falso a perturbação foi conseguida pela adição de um chiclete.
É uma propaganda da Trident.
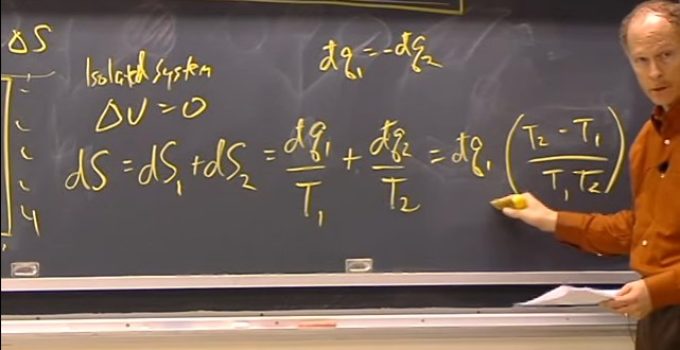
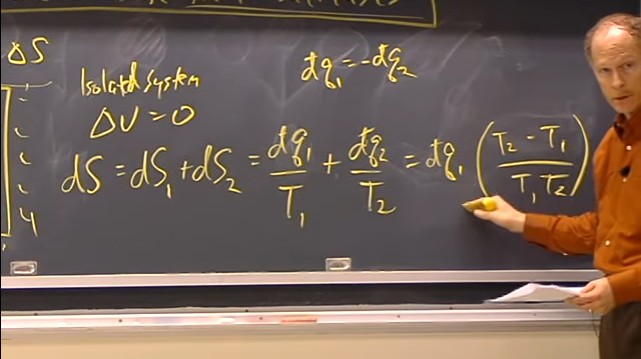
Nesta aula foram abordados detalhes sobre a entropia de um sistema e de suas vizinhanças, com considerações sobre processos reversíveis e irreversíveis.
O professor demonstra também a variação de entropia que ocorre em uma mistura, em uma compressão, no caso do aumento de temperatura e em uma mudança de fase.
Aula 10
Vídeo em inglês.