Você pode sentir o sabor do alho… pelos pés? A química responde!
Imagine provar alho sem colocá-lo na boca — na verdade, sem sequer cheirá-lo. Pode parecer improvável, mas esse é exatamente o fenômeno curioso demonstrado em um vídeo produzido pela American Chemical Society, no canal Reactions, que traz à tona um surpreendente truque de química alimentar: a capacidade de “sentir” o sabor do alho através da sola dos pés.
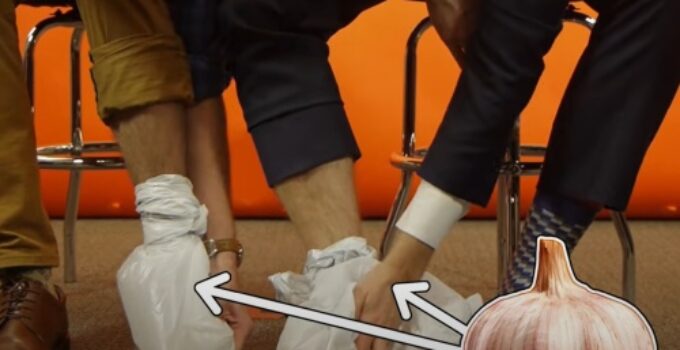
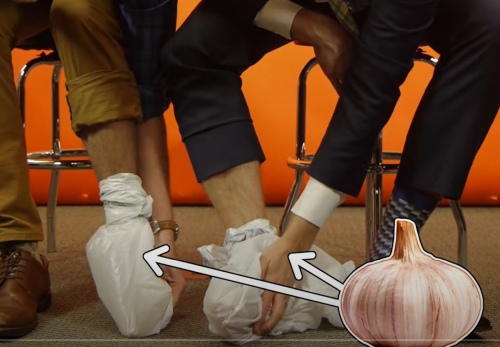
O experimento começa de forma inusitada: dois participantes se sentam em bancos, descalçam-se e colocam fatias de alho cru dentro de sacos plásticos, que depois são amarrados em torno de seus tornozelos. O narrador explica que a química nos permite experimentar alimentos de maneiras inesperadas — e esta é, sem dúvida, uma delas.
A ideia é apresentada como um “truque de festa”, e o vídeo recomenda alguns cuidados para garantir que o resultado seja mesmo causado por processos químicos, e não por simples inalação do cheiro do alho. O dente de alho deve ser fatiado em uma sala separada e isolado em um saco bem fechado. Só então, em outro ambiente sem qualquer traço de odor, os participantes devem colocar os pés descalços dentro do saco contendo o alho e mantê-los assim por cerca de uma hora.
Após esse tempo, os participantes relatam sensações surpreendentes: um sabor intenso de alho começa a surgir na boca, descrito como “ondas de sabor”, às vezes com um leve toque metálico. Além disso, o cheiro também se torna perceptível, mesmo sem contato direto com o alho no ambiente.
A explicação científica por trás desse fenômeno é fascinante. Não se trata de papilas gustativas nos pés, evidentemente. O responsável é um composto chamado alicina, presente no alho cru. Essa molécula possui propriedades químicas que a tornam capaz de atravessar as barreiras da pele — tanto as lipídicas (oleosas) quanto as aquosas. Uma vez absorvida, a alicina entra na corrente sanguínea e circula pelo corpo até atingir os receptores de sabor e olfato, localizados na boca e no nariz. É aí que o corpo “percebe” o alho, mesmo sem consumi-lo da forma tradicional.
O uso dos sacos plásticos é um detalhe importante: eles impedem que o cheiro do alho se espalhe pelo ambiente, assegurando que o efeito observado decorre unicamente da absorção transdérmica da alicina — ou seja, sua entrada no corpo através da pele.
Vídeo com legenda em português. Ative a exibição das legendas pelo YouTube.











