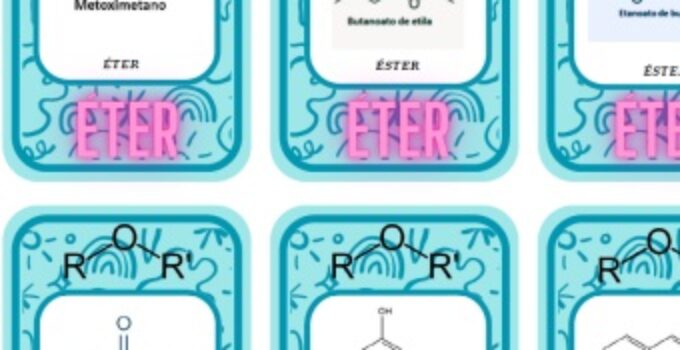
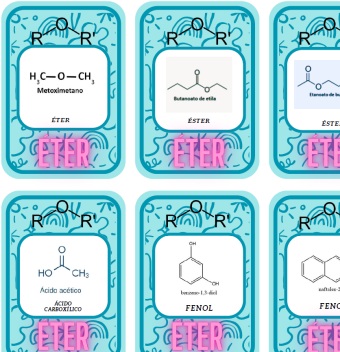
Vídeo sobre o ácido tartárico


Ainda estamos bem longe do Natal, mas em dezembro de 2015 foi lançado um vídeo especial no YouTube, no canal Periodic Videos, trazendo uma seleção curiosa: presentes com temas químicos enviados por telespectadores e coletados durante viagens ao redor do mundo.
O primeiro destaque da série é um depósito sólido retirado de um barril de vinho em uma vinícola suíça. Esse local, por sinal, pertence ao presidente da Academia Suíça de Ciências — um detalhe que torna o presente ainda mais interessante. O material foi solicitado pelo próprio apresentador e, segundo informado, trata-se de ácido tartárico, embora também possa ser um tartarato.
Mas por que isso importa para a química?
O ácido tartárico é uma molécula fascinante. Foi uma das primeiras a demonstrar a existência de formas quirais — as versões “canhota” e “destra” de uma substância, um conceito fundamental em química orgânica e bioquímica. Além disso, uma pequena quantidade desse ácido permanece no vinho, contribuindo com seu sabor característico.
E a celebração não termina por aí: o apresentador promete revelar outros presentes químicos ao longo dos 12 dias de Natal. Uma ótima oportunidade para quem ama ciência e quer conhecer curiosidades envolvendo elementos, compostos e histórias surpreendentes da química no nosso dia a dia.
Veja abaixo o vídeo sobre o Ácido Tartárico. Com legenda em português – ative a legenda pelo YouTube.
Leia também:
– Scientia Vitis: Decantando a Química do Sabor do Vinho