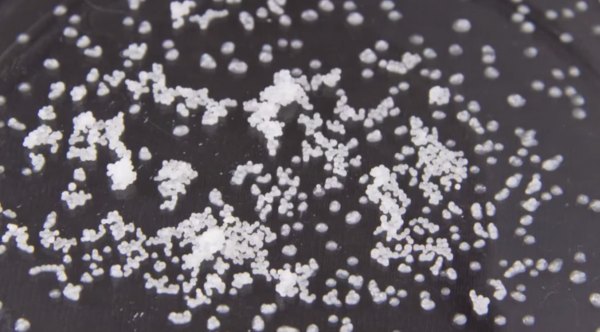
Neve falsa


O polímero poliacrilato de sódio absorve água muito facilmente e o Professor Martyn Poliakoff utiliza um pouco desse material em pó para brincar de fazer algo que ele chamou de ‘neve falsa’.
No vídeo abaixo é visível que a absorção da água ocorre de forma muito rápida e com uma liberação de um pouco de calor, segundo o Professor Martyn. Seguida da explicação do motivo pelo qual o polímero consegue absorver tanta água tão rapidamente.
Com legendas em português. Ative as legendas usando o botão CC que aparece no vídeo.
Já fiz alguns testes com essas fraldas super absorventes. Não fiz de uma forma controlada e precisa (peço desculpas ao pessoal da química analítica 😉 ), mas posso dizer que uma dessas fraldas pequenas consegue absorver em torno de 900 ml de água. Claro que não seria nada confortável ter em contato com a pele uma fralda assim encharcada. Se você abrir uma fralda não encontrará o polímero poliacrilato de sódio puro, mas uma mistura dele com algodão.
No link abaixo veja um artigo que dá uma dica de um experimento com esse tipo de material
Polímeros superabsorventes e as fraldas descartáveis: Um material alternativo para o ensino de polímeros
Texto escrito por Prof. Dr. Luís Roberto Brudna Holzle.