
O professor Stephen Liddle realiza um impressionante experimento utilizando dietil zinco; mostrando que o zinco está longe de ser um elemento chato.
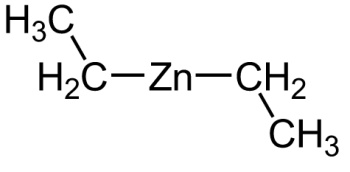
Dietil zinco
Em um vídeo anterior a queima do dietil zinco resultou em uma chama com cor amarela, mas que na verdade deveria ser azul. Para minimizar a contaminação, o novo experimento foi feito com uso de uma seringa de plástico e filmado em câmera super lenta.
Simon Woodward, da Universidade de Nottingham, fala também sobre a descoberta do dietil zinco pelo pesquisador Edward Frankland e sobre o possível exagero na descrição da violência da reação do composto com a água.
O vídeo não apenas demonstra a manipulação do dietil zinco, mas também mergulha na intrigante história de sua descoberta e destaca suas multifacetadas aplicações na química orgânica, com ênfase na síntese de uma variedade de compostos. Essa experiência oferece uma compreensão aprofundada das complexas reações químicas que envolvem compostos organometálicos, ao mesmo tempo que ressalta a estética intrínseca e os potenciais perigos inerentes a essas substâncias.
Vídeo com legendas em português. Ative as legendas pelo vídeo no Youtube.

Texto e legenda escritos por Luís Roberto Brudna Holzle – Professor Doutor na Universidade Federal do Pampa ( luisholzle@unipampa.edu.br )




