A pesquisa sobre energia nuclear dedica uma boa dose de esforços no entendimento da estabilidade físico-química e segurança dos resíduos ainda radioativos, resultantes da atividade de geração de energia por meio de um reator nuclear.
Nos EUA um dos orgãos que trabalha na área é o Pacific Northwest National Laboratory (PNNL), e uma das pesquisas investiga a formação de depósitos minerais em resíduos radioativos de natureza sólida ou líquida.
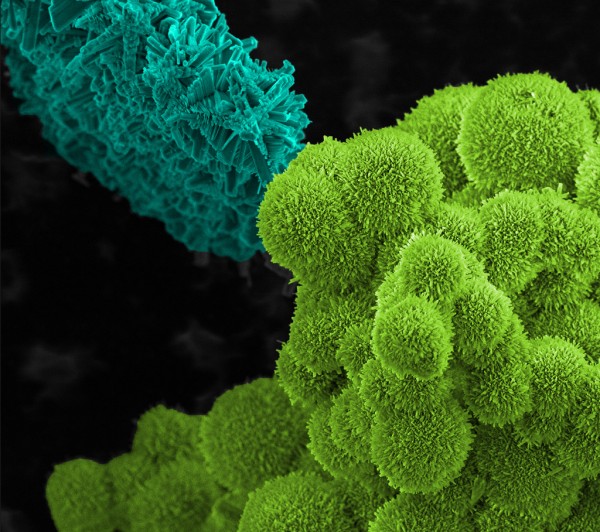
Resíduos líquidos podem apresentar formação de mineralizações bem características, como é o caso do mineral chamado de cancrinita, originado quando os compostos solúveis aluminato de sódio, silicato, carbonato e nitrato precipitam.
Nos tanques de resíduo esta cancrinita foi identificado como um capturador de íons nitrato – normalmente solúveis em água e que podem escapar dos resíduos indo parar em águas subterrâneas. Tal captura é de interesse dos pesquisadores, pois evitaria a mobilidade do material radioativo, minimizando o risco de contaminação ambiental durante o longuíssimo prazo pelo qual o resíduo radioativo deve ser estocado.
Os membros do time do PNNL, responsáveis pela pesquisa, são: Paul MacFarlan, Edgar Buck, Bruce McNamara e Cal Delegard.
O material foi coletado dos resíduos estocados no sítio de Hanford, sudeste do estado de Washington, gerados na época em que se produzia plutônio.
Provavelmente a imagem foi obtida por meio de uma microscopia eletrônica de varredura; e neste caso as cores da fotografia são usadas apenas para diferenciar as diferentes estruturas visíveis no caso.
Os resultados da pesquisa foram publicados em 2004, no ‘Environmental Science & Technology’, em artigo entitulado ‘Precipitation of Nitrate−Cancrinite in Hanford Tank Sludge’ (DOI: 10.1021/es034943i)
Imagem em licença Creative Commons (by-nc-sa 2.0), via PNNL – Pacific Northwest National Laboratory.
Texto escrito e adaptado por Prof. Dr. Luís Roberto Brudna Holzle.
Imagem encontrada por Lígia Bartmer.


![]()