Colar para químicos

Mais um daqueles badulaques que podem agradar os químicos.
Bijuterias para químicos não são novidade, mas a inovação deste artesanato é usar a tabela periódica como inspiração.


Mais um daqueles badulaques que podem agradar os químicos.
Bijuterias para químicos não são novidade, mas a inovação deste artesanato é usar a tabela periódica como inspiração.



O cério (Ce) é utilizado na composição de fornos auto-limpantes, para obter vidros de cor amarela e é também empregado em síntese orgênica.
Veja estas e outras informações no vídeo abaixo.
O vídeo tem legendas em português!

Uma interessante camiseta apresenta uma relação da porcentagem mássica dos elementos químicos presentes no corpo humano.
Analisando os números é possível perceber que para uma pessoa que pesa 70kg, o corpo teria uma massa de 43kg de oxigênio, 16kg de carbono, 7kg de hidrogênio, 1,8kg de nitrogênio, …

Veja mais algumas informações na Wikipedia
https://en.wikipedia.org/wiki/Chemical_makeup_of_the_human_body
https://en.wikipedia.org/wiki/Composition_of_the_human_body
Fonte Geekologie

Como a maioria já deve saber, o urânio é um elemento radioativo. Isto é, possui capacidade de sofrer fissão nuclear. Para deixar mais claro sua principal função é preciso entender alguns conceitos como:
*Radioatividade
*Decaimento
Radioatividade
Embora o decaimento e a radioatividade sejam aspectos diferentes a radioatividade tem uma ligação com decaimento. Um átomo ou composto radioativo é aquele tem a capacidade de emissão de radiação (nome dado para emissão de energia em forma de partículas ou ondas), no caso a radioatividade é parte da radiação relacionada a núcleos instáveis.
Decaimento
Decaimentos como já citados tem relação com a radioatividade, mas qual seria a relação? A relação é que a radioatividade é a emissão de partículas que acontecem devido ao decaimento. Mas o decaimento seria o quê? É a capacidade de alguns átomos (e seus isótopos) de perderem prótons, nêutrons, elétrons e raios gama.
A perda de prótons e nêutrons é denominado decaimento (alfa), a qual o átomo perde dois nêutrons e dois prótons, o núcleo de Hélio.
A perda de elétrons é denominada decaimento (beta) no qual o átomo perde apenas elétrons.
A emissão de raios gama ocorre com a reação dos elétrons e pósitrons (elétrons de carga positiva), assim causando a emissão de energia.
Existem também variações desses decaimentos como do decaimentos alfa apenas nêutrons ou do decaimento alfa com pósitrons também.
Aplicações do Urânio
Uma das principais aplicações é na produção de energia, pois a principal característica é que quando um átomo sofre decaimento ele libera energia, mas para acelerar o decaimento, o urânio é bombardeado com nêutrons que aceleram o processo, assim essa energia pode ser aproveitado para aquecer água, que posteriormente é usada para gerar energia elétrica.

Texto de Dison Franco


Devo desculpas pelo silêncio sobre a síntese de um novo elemento na tabela periódica, provisoriamente batizado de Copernício (Copernicium), em homenagem a Nicolau Copérnico.
O elemento, inicialmente pré-batizado de unúnbio (Ununbium), foi criado artificialmente em 9 de fevereiro de 1996 por uma equipe alemã chefiada por Peter Armbruster e Sigurd Hofmann. Esta síntese foi obtida pela união de átomo de zinco-70 com um átomo de chumbo-208, obtida pela aceleração de núcleos de zinco sobre um alvo de chumbo. Entrando assim na tabela com um número atômico de 112.
Mesmo tendo ocorrida em 1996, a síntese precisou passar por um processo de reconhecimento do resultado obtido e só obteve o selo de aprovação da IUPAC em 11 de junho de 2009.
Não podemos nos apressar em mudar todas as tabelas periódicas para o novo nome do elemento, pois a confirmação do batismo só será divulgada em janeiro de 2010. Como você pode perceber, tudo é feito da maneira mais critriosa possível, para evitar desentendimentos e erros de avaliação.
–
(em breve vídeos com legendas em português)
Gostei da camiseta com uma tabela periódica que brilha no escuro!
Texto escrito por Prof. Dr. Luís Roberto Brudna Holzle ( luisbrudna@gmail.com ) – Universidade Federal do Pampa – Bagé.
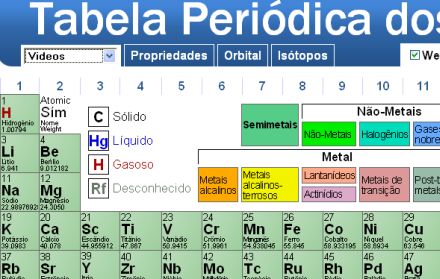
As tabelas periódicas feitas em flash tem uma boa interatividade. São de uso rápido e bem intuitivas.
Nesta tabela é possível acessar as propriedades dos elementos da tabela, incluindo informações sobre ponto de fusão, ebulição, eletronegatividade, afinidade, etc.
Confira também as valiosas informações sobre orbitais e isótopos.
No menu, no topo esquerdo da tela, você também pode escolher se quer ver informações da Wikipédia, WebElements, vídeos ou fotos ao clicar sobre cada elemento!

Clique para acessar
Uma versão em português está disponível em
http://www.ptable.com/
Veja também
Tabela periódica com centenas de vídeos.